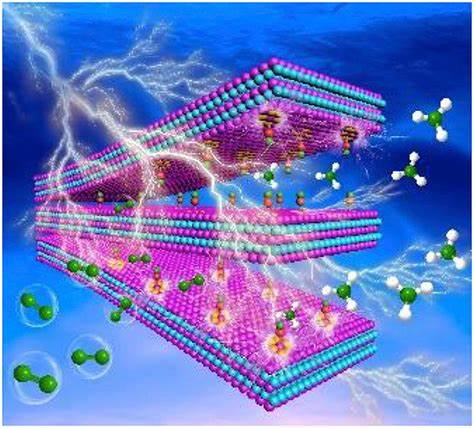
Bahan dua dimensi (2D) telah menarik perhatian besar dari komunitas ilmiah di berbagai bidang penelitian, termasuk penelitian biomedis, karena banyak sifat menarik dan uniknya. Sejak penemuan graphene pada tahun 2004, berbagai nanomaterial 2D, seperti dichalcogenides logam transisi (misalnya, TiS2, MoS2, dan WS2), nanosheet fosfor hitam, hidroksida ganda berlapis, karbon nitrida grafit, boron nitrida 2D, logam-organik 2D. kerangka kerja, oksida logam transisi, dll., Telah dikembangkan dan dieksplorasi sebagai agen terapi kanker. Baru-baru ini, MXenes, bahan 2D baru yang terdiri dari karbida logam transisi, nitrida, atau karbonitrida, telah menarik daya tarik luas di bidang pengobatan tumor fototermal (PTT) sebagai agen terapi, pencitraan, dan penghantaran obat karena sifatnya yang ringan. -efisiensi konversi panas, nomor atom tinggi dan perilaku paramagnetik, dan luas permukaan tinggi. Namun, agen fototheraml MXene (PTA) sangat tidak stabil dalam lingkungan berair/oksidatif karena gugus fungsi terminalnya (–F, –OH, atau –O) rentan terhadap oksidasi dan cenderung berkumpul dalam larutan fisiologis, misalnya, cairan tubuh yang disimulasikan. dan saline buffer fosfat, yang pada akhirnya mengarah pada kemanjuran PTT yang rendah. Tantangan saat ini menghambat penerapan platform nano berbasis MXene dalam biomedis.
Dalam karya ini, kami menggunakan pencitraan fluoresensi (FL) untuk mengembangkan lembar nano theranostik multifungsi berbasis MXene dengan sifat terapeutik foto dan kelaparan untuk mencapai efisiensi terapeutik kanker yang tinggi melalui efek kooperatif. Kami memilih titanium karbida (Ti3C2) MXene sebagai PTA dalam penelitian ini. Pertama, stabilitas Ti3C2 MXene ditingkatkan melalui modifikasi permukaan dengan antioksidan SA dan DA (DA/SA@Ti3C2 disingkat DSTC). SA dan DA tidak hanya meningkatkan stabilitas MXene dengan menahan oksidasi tetapi juga memungkinkan fungsionalisasi dengan molekul biologis. Kemudian, GOx dan Ce6 PS secara berurutan dilampirkan ke permukaan DSTC melalui kopling karbodiimida sederhana untuk memberdayakannya dengan pencitraan GST dan FL dan properti PDT, masing-masing (Ce6/GOx@SDTC disingkat CGDSTC).
Kandungan
Setelah akumulasi di lingkungan tumor yang kaya glukosa, NSs CGDSTC dapat mengubah glukosa menjadi asam glukonat karena adanya GOx dan akibatnya membuat sel tumor peka terhadap efek fototermal dengan membatasi glikolitik tumor jalan. Iradiasi foto dengan laser 808 dan 671 nm menyebabkan penghancuran sel tumor melalui efek PDT yang dimediasi Ti3C2 dan PDT yang dimediasi Ce6, masing-masing. Selanjutnya, iradiasi laser dengan laser 808 nm menambah efisiensi GST dan PDT, dengan suhu yang lebih tinggi menyebabkan peningkatan kadar oksigen tumor dan aktivitas katalitik GOx. Selain itu, NS CGDSTC memungkinkan visualisasi lokalisasi mereka ke dalam sel tumor karena sifat pencitraan FL yang diberkahi oleh Ce6. Secara keseluruhan, efisiensi terapeutik spesifik kanker yang tinggi dicapai dengan NS CGDSTC kami yang disintesis melalui efek kooperatif antara kelaparan dan fototerapi, yang secara efektif akan menghilangkan tumor dengan cara yang lebih efisien dan lebih aman.
Terbukti bahwa NSs CGDSTC kompatibel dengan sel di bawah kondisi nonstimulus dan bahwa mereka mampu memperburuk fitur pembunuh sel, seperti hipertermia, penurunan konsentrasi glukosa, dan ROS. Oleh karena itu, efisiensi pembunuhan sel dari NS yang disintesis di bawah pengaruh berbagai rangsangan dipelajari baik secara individu atau dalam kombinasi.
Untuk memverifikasi efek fototermal dan fotodinamik NS pada kematian sel, sel HeLa diiradiasi dengan laser nm 808 (2 W/cm2) dan 671 (0,5 W/cm2), masing-masing, selama 10 menit setelah inkubasi dengan konsentrasi NS berbeda selama 24 jam. H. Untuk efek kombinasi PTT dan PDT, kedua laser diterapkan pada sel kanker secara bersamaan. Iradiasi laser saja tidak menyebabkan kematian sel. Namun demikian, kematian sel bergantung pada konsentrasi dengan adanya CGDSTC NS dan laser, yang dapat dikaitkan dengan sifat fototermal dan fotodinamik yang bergantung pada konsentrasi dari NS. Ketika konsentrasi NS meningkat, persentase sel yang hidup di semua perlakuan menurun, dan secara signifikan lebih sedikit pada kombinasi PTT dan PDT dibandingkan dengan PTT atau PDT saja. Untuk 200 ppm CGDSTC NS, PTT saja dan PDT saja menginduksi kematian sel 76% dan 79%, sedangkan kombinasi PTT dan PDT menginduksi kematian sel 90%.
Glukosa adalah nutrisi penting untuk pertumbuhan sel kanker. Dengan demikian, adalah mungkin untuk menginduksi kematian sel dengan kelaparan glukosa dalam sel. Karena NS CGDSTC mampu menguraikan glukosa dan memodulasi stres oksidatif di lingkungan mikro, kemampuan NS untuk menginduksi toksisitas sel melalui kelaparan glukosa diverifikasi dengan memvariasikan konsentrasinya dalam media kultur. Dengan adanya glukosa saja, viabilitas sel sebanding dengan kontrol, menunjukkan bahwa glukosa tidak menyebabkan toksisitas sel. Namun, dengan adanya glukosa (50 g/ML) dan CGDSTC NSs, viabilitas sel turun secara signifikan dibandingkan dengan kontrol. Penurunan ini lebih besar pada konsentrasi NS yang lebih tinggi karena aktivitas katalitik yang tinggi, menunjukkan bahwa konsumsi glukosa NS menyebabkan kematian sel dengan menginduksi kelaparan glukosa. Pada 200 ppm NS dan 50 g/mL glukosa, viabilitas sel sekitar 20%.
Karena fototerapi dan metabolisme glukosa dapat mengurangi kerugian satu sama lain, yaitu, aktivitas katalitik, sensitivitas terapeutik, dll., dan menyebabkan kerusakan sel kanker yang diperkuat melalui kerjasama win-win, efek sinergis dari berbagai modalitas terapi NS pada viabilitas sel diselidiki lebih lanjut. Untuk ini, sel HeLa diinkubasi dengan glukosa (50 g/mL) dan berbagai konsentrasi NS dan diradiasi dengan laser 808 dan 671 nm selama 10 menit. Pada semua konsentrasi NS yang diuji, kombinasi terapi kelaparan glukosa dan fototerapi menunjukkan kematian sel yang lebih baik daripada yang diperoleh dengan PTT, PDT, PTT + PDT, atau terapi kelaparan (Gambar 1e). Secara keseluruhan, hasil ini menunjukkan bahwa CGDSTC NS memiliki potensi untuk menjadi agen terapeutik yang menjanjikan dalam pengobatan kanker.
Kesimpulan
Dalam studi ini, permukaan Ti3C2 MXene (TC) NS dimodifikasi dengan antioksidan natrium askorbat (SA) dan dopamin (DA) untuk meningkatkan stabilitasnya dalam lingkungan oksidatif dan hidrasi. Pendekatan ini tidak hanya meningkatkan stabilitas tetapi juga memungkinkan konjugasi glukosa oksidase (GOx) dan fotosensitizer (Ce6) ke permukaan TC NS dengan meningkatkan gugus fungsi yang tersedia. CGDSTC NS yang disintesis menunjukkan konversi foton-ke-panas yang sangat baik, generasi ROS, dan sifat dekomposisi glukosa berkat kehadiran TC NSs, Ce6, dan GOx, masing-masing. NS CGDSTC secara efektif diinternalisasi ke dalam sel, dan NS yang diinternalisasi meningkatkan konsentrasi ROS intraseluler pada penyinaran laser. Lebih lanjut, NS CGDSTC yang disintesis ditemukan menjadi sitokompatibel dalam kondisi nonstimulus tetapi menunjukkan toksisitas sel kanker yang lebih tinggi dengan adanya faktor stimulus seperti laser dan glukosa. Toksisitas sel kanker secara signifikan lebih tinggi dengan kombinasi kelaparan glukosa dan fototerapi daripada yang diperoleh dengan kelaparan glukosa atau fototerapi saja. Dari hasil penelitian ini, dihipotesiskan bahwa CGDSTC NSs dapat menjadi agen terapeutik yang potensial dalam pengobatan kanker. Selain itu, pendekatan modifikasi permukaan dapat diadopsi dalam penelitian MXene di masa depan karena mudah dan lancar.
Penulis: Mochamad Zakki Fahmi, S.Si., M.Si., Ph.D.
Link Asli Paper