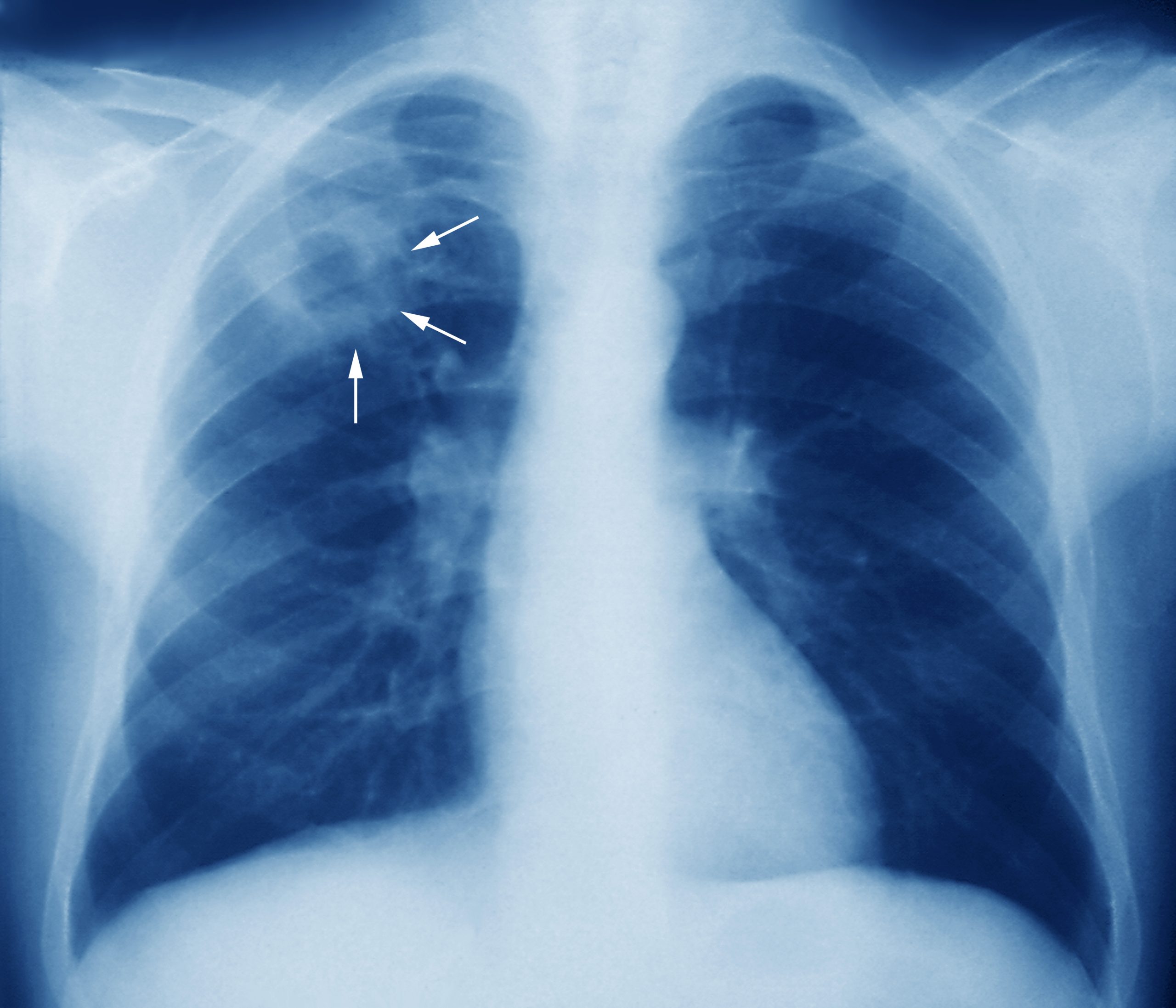
Tuberkulosis (TBC) merupakan penyakit infeksi disebabkan oleh bakteri Mycobaterium tuberculosis (MTBC), masih menjadi masalah kesehatan masyarakat seluruh dunia. Bakteri MTBC adalah species patogenik, memiliki kemampuan merusak jaringan tubuh dan menimbulkan penyakit. Bakteri MTBC memiliki molekul protein-protein yang dinamakan faktor virulens, dapat merusak jaringan tubuh.
Salah satu kelompok molekul protein yang disekresi oleh komponen kompleks molekul type VII Secretion System (T7SS5). Molekul protein dalam sistem T7SS5 memiliki 5 sistem yaitu ESX-1, ESX-2, ESX-3, ESX-4, ESX-5. Molekul protein sistem T7SS5 ini penting sebagai penentu virulensi, molekul perusak jaringan tubuh. Terutama ESX-5 system (Rv1782-Rv1798) hanya ditemukan pada Mikobateria yang tumbuh lambat seperti MTBC.
ESX-5 system memiliki empat komponen utama, molekul protein EccB5, EccC5, EccD5, dan EccE5, protein-protein ini disandi oleh gen-gen eccB5, eccC5, eccD5, eccE5. Beberapa peniliti melaporkan adanya mutasi pada gen tersebut. Mutasi gen dapat menjadikan suatu variasi gen dan dapat menghasilkan suatu variasi molekul protein.
Bentuk mutasi yang sering ditemukan Single Nucleotide Polymorphism (SNP), diversitas unik dapat terjadi pada beberapa gen, SNPs dapat menimbulkan efek penting pada fenotipe Mikobateria, dan dapat mempengaruhi pathogenesis infeksi MTBC (proses mekanisme terjadinya kerusakan jaringan tubuh dan menimbulkan penyakit), epidemiologi molekuler, marker phylogenetic, kekebalan terhadap obat anti-TB.
Penelitian ini fokus studi pada karakteristik eccB5 pada bakteri MTBC galur murni (wild type) dan strain mutant (1277 A/T), studi observasional pada ekspresi gen dan pemurnian protein rekombinan untuk menentukan peran fungsional molekul protein EccB5. Peran fungsional EccB5sangat homolog dengan EccB1, salah satu fungsi aktivitas Adenosine Triphosphatase (ATPase).
Metode penelitian, studi fungsi molekul protein EccB5 disandi gen eccB5, menggunakan suatu docking experiment dengan SWISS model. Pengukuran ATPase dari hasil pemurnian potongan molekul protein EccB5 dari MTBC wild type dan mutant. Langkah prosedur: Prinsip Plasmid dan Vektor ekspresi gen, digunakan plasmid pCold I (Takara®, Shiga, Japan), sebagai suatu vektor ekspresi gen digunakan E.coli strain DH5α (cloning host), dan E.coli strain Rosetta-gammi B (DE3) sebagai expression host.
Konstruksi Plasmid untuk ekspresi molekul protein EccB5, potongan gen eccB5 dilakukan konstruksi ke dalam plasmid pCold I, kemudian recombinant plasmid dilakukan cloning ke dalam sel host E.coli DH5α.
Ekspresi protein recombinant EccB5 dalam sel E.coli DE3, plasmid cloning ditransformasi ke dalam E.Coli DE3. Ekstraksi dan Purifikasi molekul protein EccB5 recombinant, sel-sel E.coli DE3 transformen pembawa rec.plasmid dipanen, protein rekombinan diekstraksi menggunakan reagensia Bug Buster® (Merck, Tokyo, Japan). Protein ekstrak (crude protein) dimurnikan menggunakan Talon® metal resmi (Clontech Laboratories Inc. CA).
Pemisahan molekul protein menggunakan sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE) dan Western Blok. Aktivitas ATPase, diukur menggunakan kit uji ATPase (Sigma-Aldrich).
Modeling molekuler protein EccB5, menggunakan SWISS model. Modeling protein eccB5 hexamer menggunakan SymmDock. Suatu model dengan nilai komplementer tertinggi pada bentuk geometric dipilih sebagai model eccB5. Molecular Operating Environment (MOE) digunakan sebagai platform untuk simulasi docking dengan ATP.
Hasil Penelitian, Prediksi struktur protein eccB5 bentuk untuk molekul protein menggunakan software PyMol. Hasil analisis menunjukkan suatu Regio transmembran pada molekul protein EccB5 pada posisi residu asam amino 54-76. Sekuens nukleotida 1-417 didelesi, dan primer dirancang dimasuki gen starting pada urutan nukleotida 418 sampai stop codon. Berat molekul protein rekombinan diperkirakan 38,6 kDa. Aktivitas ATPase, tidak dideteksi ATPase, tidak ada perbedaan antara wild type dengan mutant.
Pada modeling protein EccB5 menggunakan SWISS model, struktur hexamer oligomer diprediksi menggunakan Symm Dock, kebanyakan fungsi ATPase sebagai hexamer seperti molekul EccB1. Simulasi MOE, molekul ATP menunjukkan suatu model tongkat dan lokasi pada interface molekul protein EccB5, molekul ATP model pita berlokasi pada EccB5 hexamer.
Rekombinan potongan protein EccB5 MTBC wild type dan mutant berhasil diekspresi dalam sel E.coli DE 3, tidak perbedaan pertumbuhan E.coli DE 3 pembawa rec eccB5. MTBC wild type dengan mutant, namun hasil ekspresi molekul protein rec.eccB5 mutant lebih rendah dari pada wild type.
Pengukuran aktivitas ATPase, tidak terdeteksi, dan tidak ada perbedaan antara wild type dengan mutant. Peneliti lain melaporkan EccB1 adalah ATPase periplasmik, dan EccB5 homolog dengan EccB1 dalam ESX system. Pada penelitian ini, diekspresi potongan molekul protein EccB5, kemungkinan fungsi ATPase hilang bila bagian N-terminal motif PXZNLXSARI dihilangkan.
ATPase merupakan salah satu enzym penting pada bakteria, untuk driving substract melewati ATP dephosphorylation. Molekul protein EccB5 hexamer berfungsi sebagai bagian tabung transportasi merupakan bagian dari kompleks protein besar sistem membrane type VII secretion membrane system. Simpulan: Molekul protein EccB5 berperan sebagai tabung saluran yang merentang dan menembus membran sel bakteri MTBC sampai ke dalam sitoplasma, uptake nutrisi, integritas dinding sel, bakteri bertahan hidup dan berkembang biak, dan merusak sel-sel jaringan paru-paru, dengan demikian molekul protein EccB5 memiliki peran penting sebagai faktor virulens. Pemahaman dasar aktivitas molekul protein EccB5 ini dapat menjadi rancangan target kerja obat anti-TB. (*)
Penulis: Ni Made Mertaniasih
Informasi detail riset ini dapat dilihat pada tulisan kami di :